pH del terreno

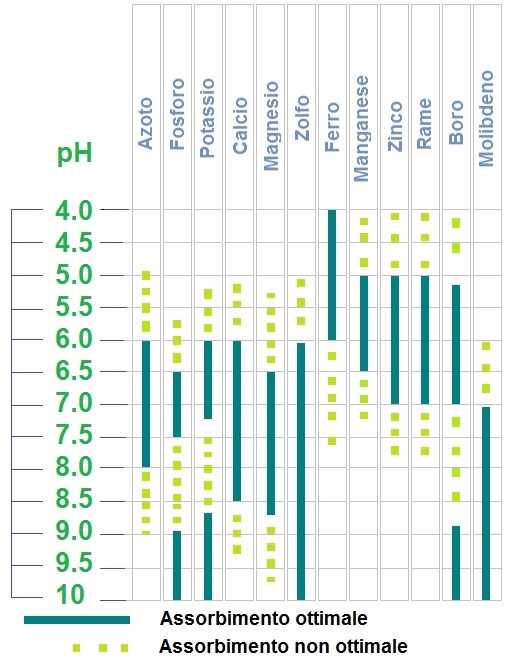
Il tenore di pH come principale indicatore dell'attività biochimica del suolo, assume un ruolo base nella diagnostica qualitativa dei terreni come predisposizione alla crescita o al degradamento della vita vegetale. Agronomi e appassionati sono spinti a indagare sempre meglio i legami tra la biochimica delle colture e il potenziale elettrochimico misurato dal pH nel terreno, grazie anche alla sempre migliore affidabilità, efficienza e comodità d'impiego degli strumenti dedicati.
Il pHmetro digitale ha raggiunto ottimi livelli di accuratezza e praticità, sostituendosi egregiamente nelle analisi quotidiane, alla tecnica colorimetrica di laboratorio, sicuro standard di riferimento metrologico ma decisamente più laboriosa e dispendiosa nel tempo come nelle risorse impiegate.
Basofile o acidofile
La suddivisione teorica delle piante in due categorie, a seconda si adattino ad ambienti acidi piuttosto che basici o alcalini, ha previsto un terzo campo intermedio più esteso, attorno alla neutralità, che raggruppa la maggior parte delle tipologie senza problemi di adattabilità e di conseguente sopravvivenza.
Alcune classificazioni dei terreni in funzione del pH riportate in letteratura:
| Giardini 1986 Denominazione | Gamma pH | Gessa & Testini 1989 Denominazione | Gamma pH |
| Fortemente acidi | < 5.5 | Peracidi | < 5.3 |
| Acidi | 5.5 - 6.0 | Acidi | 5.4 - 5.9 |
| Subacidi | 6.0 - 6.8 | Subacidi | 6.0 - 6.7 |
| Neutri | 6.8 - 7.3 | Neutri | 6.8 - 7.2 |
| Sub-basici | 7.3 - 8.0 | Sub-alcalini | 7.3 - 8.1 |
| Basici | 8.0 - 8.5 | Alcalini | 8.2 - 8.8 |
| Alcalini | > 8.5 | Peralcalini | > 8.8 |
Preparazione alla misura
La misura diretta nel terreno per inserzione di un apposito elettrodo a punta nel suolo è, per quanto possibile, di scarso significato oltre che dannosa per la sua durata, inducendo a errori anche grossolani.
Perchè ci si possa fidare, il valore aleatorio del pH è determinabile attraverso la stabilità del grado di soluzione acquosa in cui può essersi disciolto.
La idrosolubilità e conseguente grado di dissociazione ionica stabile per idrolisi, consente una valida e ottimale lettura del pH.
I metodi migliori raccomandati, riconosciuti SSIS sono di campionatura con volumi noti in due tipi di soluzioni: acquosa o salina.
- a1 Soluzioni terreno/acqua deionizzata, in rapporti da 1:1 a 1:2
- s1 Soluzioni terreno/CaCl2 con solvente a 0,01M/L oppure
- s2 Soluzioni terreno/KCl con solvente a 1 M/L
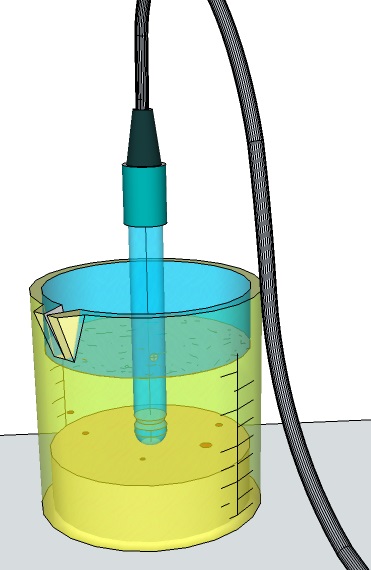
Con l'utilizzo di una soluzione acquosa (a1), i valori ottenuti sono mediamente più elevati di quelli delle due soluzioni saline (s1,s2) e diversi tra loro a seconda che la misura avvenga con diaframma dell'elettrodo a contatto del sedimento, o del liquido sovrastante o della sospensione (surnatante).
Più omogenee e ripetibili sono invece le misure ottenute con soluzioni saline, perchè più stabili rispetto alle prime a base d'acqua. Il motivo risiede nella spiccata propensione dell'acqua stessa alla attività di dissociazione ionica per idrolisi con il soluto.
In più, l'influsso dell'umidità del terreno, la sua ossidazione, il grado di saturazione raggiunto dalla soluzione acquosa, rappresentano un importante indice di variabilità nel tempo.
Partendo da un valore di riferimento a terreno campione, disciolto in soluzione salina pH (CaCl2); pH (KCl)) in rapporto volumi noto, è interessante stabilirne la successiva variazione relativa dell'attività idrogenionica misurata con il pHmetro, o per campionamento temporale sistematico, o al suolo con un opportuno sistema di monitoraggio in linea.
Esempio:
Si pone in un beaker contenente 25ml di soluzione 1 M di KCl, 10 g (rapporto 1:2,5 peso/volume) di terreno campione, deidratato e finemente sminuzzato con setaccio 2 mm. Si agita e si lascia riposare per 30". La determinazione potenziometrica si effettua immergendo gli elettrodi nella sospensione limpida. Il valore di pH risulta più basso rispetto a quello dell'acidità attiva.
Sviluppi nelle tecniche di monitoraggio
Letture in tempo reale di come cambino i valori di pH "naturalmente" sul campo, sotto l'azione di acqua pluviale o irrigua, correlata all'influenza della libera attività dei colloidi tra le basi e i nutrienti, diventa un valido banco di prova per la raccolta di informazioni approfondite, sicuramente utili e significative.
Pubblicato in: Supporto alle applicazioni
